Lecciones de las defensas anfitrionas de los murciélagos, un reservorio viral único (Revista Nature, traducción automática)
Abstract
Ha habido varios brotes importantes de enfermedades virales emergentes, como Hendra, Nipah, Marburg y enfermedades del virus del Ebola, síndrome respiratorio agudo grave (SARS) y síndrome respiratorio de Oriente Medio (MERS), así como la pandemia actual de la enfermedad por coronavirus 2019 (COVID-19). En particular, todos estos brotes se han relacionado con la presunta transmisión zoonótica de virus transmitidos por murciélagos. Los murciélagos, el único mamífero volador, muestran varias características adicionales que son únicas entre los mamíferos, como una larga vida útil en relación con el tamaño del cuerpo, una baja tasa de tumorigenesis y una capacidad excepcional para albergar virus sin presentar enfermedades clínicas. Aquí discutimos los mecanismos que sustentan el sistema de defensa del huésped y la tolerancia inmune de los murciélagos, y sus ramificaciones para la salud humana y las enfermedades. Estudios recientes sugieren que 64 millones de años de evolución adaptativa han dado forma al sistema de defensa del huésped de los murciélagos para equilibrar la defensa y la tolerancia, lo que ha dado lugar a una capacidad única para actuar como un huésped de reservorio ideal para los virus. Las lecciones de la eficaz defensa de los murciélagos nos ayudarían a comprender mejor la evolución viral y a predecir, prevenir y controlar mejor futuros derrames virales. El estudio de los mecanismos de tolerancia inmune en los murciélagos podría conducir a nuevos enfoques para mejorar la salud humana. Creemos firmemente que es hora de centrarse en los murciélagos en la investigación en beneficio de los murciélagos y la humanidad.
Principal
La pandemia actual de COVID-19—causada por el coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2)— ha causado más de 75.704.857 casos y ha causado 1.690.061 muertes (al 21 de diciembre de 2020)1. Aunque la posibilidad de un huésped intermedio sigue siendo una pregunta abierta, se cree que el SARS-CoV-2 tiene un origen ancestral en los murciélagos2—con la similitud más cercana con el coronavirus del murciélago RaTG133. Conceptualmente, un brote causado por un virus emergente de murciélagos zoonóticos no sólo se ha predicho, sino que4,5,6. La continua injerencia humana en los ecosistemas naturales ha dado lugar a muchos brotes en las últimas décadas6. Junto con conocidos virus transmitidos por murciélagos como la rabia y el virus del Ebola7,8, existe una serie de coronavirus diversos en los murciélagos que han confirmado el potencial de contagio de brotes graves de enfermedades, incluido el coronavirus del síndrome respiratorio agudo grave (SARS-CoV) (que surgió en 2003) y los brotes en curso asociados con el coronavirus del síndrome respiratorio de Oriente Medio (MERS-CoV) (desde 2012). La capacidad de los murciélagos para albergar muchos virus, y coronavirus zoonóticos en particular, puede resultar de su capacidad para regular eficientemente las respuestas de los huéspedes a la infección, aunque la riqueza de las especies también puede tener un papel9. A través de factores ecológicos, rasgos biológicos o sus sistemas inmunitarios únicos subyacentes, los murciélagos pueden prevenir la patología inmune excesiva en respuesta a la mayoría de los patógenos virales. El examen de estos procesos abrirá las lecciones clave para la salud humana, desde la comprensión del envejecimiento hasta la lucha contra el cáncer y las enfermedades infecciosas.
Biología básica de los murciélagos
A través de los pedidos de mamíferos, Chiroptera (murciélagos) es un taxón rico en especies que se destaca ya que es capaz de volar con motor; los murciélagos representan 1.423 de las más de 6.400 especies conocidas de mamíferos10,11 (Tabla 1). Esta diversidad se combina con su amplia distribución geográfica, que sólo evita las regiones polares, los climas desérticos extremos y algunas islas oceánicas12. Los murciélagos son especies clave de las que otras faunas y floras dependen en gran medida de la fertilización, la polinización, la dispersión de semillas y el control de las poblaciones de insectos13,14. Los murciélagos descansan en el follaje, grietas y cuevas de roca, y árboles huecos, así como estructuras hechas por el ser humano como graneros, casas y puentes15. Diferentes especies pueden ser homo- o heterotémicas, usando hibernación o torpor episódico diario más corto para conservar energía16. Los murciélagos son propensos a la baja fecundidad y utilizan estrategias reproductivas como el almacenamiento de espermatozoides o embarazos prolongados, con ciclos reproductivos estacionales o aseasonales15. Además, consumen una amplia gama de dietas, incluyendo néctar, fruta, polen, insectos, peces y sangre (como en el murciélago vampiro común (Desmodus rotundus)). Siempre intrigantes para la humanidad, los murciélagos poseen los poderes de detección de ecolocalización y magnetocepción (la capacidad de diferenciar polar sur desde el norte), los cuales son utilizados principalmente por microbats17,18,19. Las diferencias en ecología, biología y fisiología son factores importantes que deben tenerse en cuenta en las respuestas específicas de las especies dentro de los murciélagos y en la conducción de estudios experimentales.
A pesar de las ventajas y la eficiencia del transporte aéreo, el vuelo es un modo metabólicamente costoso de locomoción20: las tasas metabólicas de murciélagos en vuelo pueden alcanzar hasta 2,5-3× las de mamíferos terrestres que ejercen un tamaño similar21. Esta enorme demanda de energía resulta en el agotamiento de hasta el 50% de su energía almacenada en un día: los murciélagos cítarivoros catabolizan su dieta de alta energía de azúcares simples tan rápido como 8 minutos después del consumo, y los murciélagos voladores consumen alrededor de 1.200 calorías de energía por hora22,23,24. Los murciélagos poseen varias adaptaciones metabólicas y patrones de flujo de aire optimizados para eludir los gastos de alta energía que de otro modo podrían conducir a la inanición y la muerte25. Una adaptación clave es la marcada alteración de la frecuencia cardíaca, que aumenta entre un 4 y un 5× durante el vuelo hasta un máximo de 1.066 latidos por minuto24. Para compensar los altos niveles de estrés cardíaco, la bradicardia cíclica se induce de 5 a 7 minutos varias veces por hora durante el descanso, lo que puede conservar hasta un 10% de la energía disponible. A pesar de sus altas tasas metabólicas y pequeñas estaturas, los murciélagos viven sustancialmente más tiempo que los mamíferos no voladores de masa corporal similar26,27. Cuando se ajustan para el tamaño del cuerpo, sólo 19 especies de mamíferos son de mayor vida que los humanos: 18 de estas especies son murciélagos (la otra es la rata lunar desnuda)28. En promedio, la vida útil máxima registrada de los murciélagos es del 3,5× la de un mamífero placentario no volador de un tamaño similar29. Como modelo de mamíferos de antienvejeciente, los murciélagos pueden ofrecer pistas vitales en los intentos humanos de retrasar la mortalidad y mejorar la longevidad.
Estado de los murciélagos como reservorio viral único
Los murciélagos se han asociado con enfermedades infecciosas durante siglos. Su papel en la transmisión del virus de la rabia llevó a Metchnikov a investigar los macrófagos de los murciélagos frutales y sus respuestas inmunitarias en 190930. Más recientemente, se han documentado varios brotes virales nuevos o ree emergientes asociados con la propagación de los reservorios de murciélagos, y varios informes han puesto de relieve el riesgo de futuros eventos de contagio en las poblaciones humanas. Los coronavirus de ARN de una sola cadena envueltas y de sentido positivo están muy extendidos en animales (el 54% de los conocidos están asociados con murciélagos), y causan enfermedades respiratorias o entéricas leves a graves en humanos31. La asociación entre coronavirus y murciélagos comenzó a ser reconocida con el descubrimiento de coronavirus relacionados con el SRAS en murciélagos32,33,34,35. Desde entonces, los murciélagos han sido identificados como la fuente más rica de coronavirus genéticamente diversos36, incluidos los virus similares al MERS-CoV37 y una gama de coronavirus de murciélagos38,39,40. Recientemente se han notificado varias secuencias genómicos de coronavirus de murciélagos que muestran una alta similitud genética con SARS-CoV-23,41. Se cree que el creciente número de eventos de contagio de los virus de los murciélagos —y de los coronavirus en particular— se debe a la interrupción de los ecosistemas naturales que albergan murciélagos a través del cambio climático, el aumento de la presión de la urbanización de los seres humanos, el comercio de vida silvestre y los mercados de animales34,42,43 (Fig. 1). Se han financiado algunas grandes iniciativas mundiales para examinar los factores de riesgo de posibles eventos de contagio, pero la financiación de esta área de investigación se ha reducido en los últimos años44,45. Aunque se ha previsto cada vez más un evento como COVID-19, pocos científicos habrían esperado la magnitud y la velocidad de propagación de esta pandemia actual.
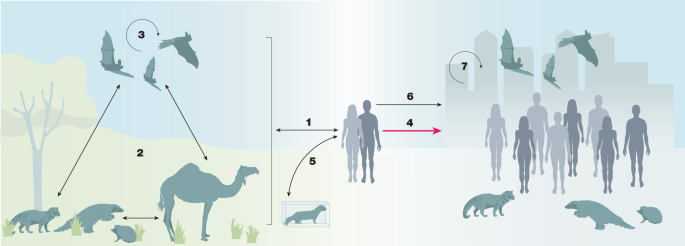
1: El potencial ciclo de transmisión zoonótica para los coronavirus.
Los coronavirus pueden transmitir naturalmente (flechas negras) entre humanos, murciélagos y otras faunas (como perros mapache, erizos, pangolines, civets de palma, camellos (como se conoce para MERS-CoV) y visón)158. Las intervenciones humanas pueden amplificar la propagación (flecha roja). Los ciclos de transmisión pueden amplificarse en zonas urbanas que normalmente corren un riesgo mínimo de exposición, aumentando la transmisión a los seres humanos y acelerando un escenario de brote. (1) Ciclos naturales de infección zoonótica de animales domésticos o vida silvestre (incluidos los murciélagos) a los seres humanos y viceversa; las poblaciones humanas en riesgo incluyen a los agricultores de guano de murciélagos, o individuos que viven y trabajan en áreas que se superponen con los hábitats de los murciélagos. (2) Ciclo enzoótico natural entre diferentes especies de vida silvestre (incluidos los murciélagos), y animales domésticos y vida silvestre. (3) Amplificación y propagación entre poblaciones de murciélagos superpuestas, como, por ejemplo, se observa entre las especies de Rhinolophidae e Hipposideridae para los coronavirus relacionados con el SARS159. (4) Infecciones zoonóticas amplificadas y propagadas a zonas urbanas a través de intervenciones humanas, incluido el comercio de vida silvestre y el aumento de la urbanización. (5) Las infecciones antropozoonóticas de los seres humanos de vuelta a animales domésticos o vida silvestre (por ejemplo, como en la agricultura de visones50). (6) Los patrones de migración humana facilitan la propagación a las zonas urbanas (por ejemplo, durante las temporadas vacacionales160). (7) Difusión viral amplificada entre humanos o animales y seres humanos en entornos urbanos densos.
También hay que destacar que los virus transmitidos por murciélagos causan brotes devastadores no sólo en los seres humanos, sino también en animales como cerdos y caballos46,47,48,49. Durante un brote a gran escala (como ocurre con la actual pandemia COVID-19), existe el riesgo de transmisión de un derrame o de zoonóticos «reversos» (antropozoonóticos) de humanos a animales, como lo han demostrado los brotes de COVID-19 en visones en dos granjas en los Países Bajos, seguidos de la transmisión de animales a humanos del virus SARS-CoV-250. También se han observado infecciones antropoonóticas del SARS-CoV-2, desde dueños de mascotas hasta gatos y perros domésticos51,52, y a los tigres y leones alojados en zoológicos53. Existe un riesgo previsto de propagación del SARS-CoV-2 a otra fauna de mamíferos de alcance libre, incluidos los grandes simios54 y murciélagos en diferentes ubicaciones geográficas55, y esta amenaza percibida ha afectado a la industria del turismo de vida silvestre en muchos países. Aunque los huéspedes intermedios como civets y pangolines han estado implicados en brotes de SARS-CoV y SARS-CoV-2 (respectivamente), estos animales exhibieron edema pulmonar e inflamación en respuesta a la infección por coronavirus relacionados con el SARS-CoV-2 (respectivamente), estos animales exhibieron edema pulmonar e inflamación en respuesta a la infección por coronavirus relacionados con el SARS-CoV-2 (respectivamente), estos animales exhibieron edema pulmonar e inflamación en respuesta a la infección por coronavirus relacionados con el SARS-CoV-2 (respectivamente), estos animales exhibieron edema pulmonar e inflamación en respuesta a la infección por coronavirus relacionados con el SARS-CoV-2 (respectivamente), estos animales exhibieron edema pulmonar e inflamación en respuesta a la infección por coronavirus relacionados con el SAR56,57,58, lo que sugiere que no son verdaderos reservorios para estos coronavirus. Por el contrario, los murciélagos carecen de signos clínicos de enfermedad cuando están infectados con la mayoría de los virus, aunque hay algunas excepciones raras. Infección de alto título con el virus Tacaribe59 o infección con cepas de lyssavirus divergentes en especies60 pueden causar síntomas graves y la muerte. El virus del filovirus Lloviu está asociado con la muerte de murciélagos en España61 y el síndrome de nariz blanca fúngica mata a los murciélagos al afectar las necesidades de energía a medida que los murciélagos despiertan de la hibernación o torpor62.
El estatus único de los murciélagos como reservorio viral se confirma aún más por el hecho de que los murciélagos albergan más patógenos zoonóticos que cualquier otra especie de mamífero conocida63,64,65. Comentarios anteriores han discutido los rasgos biológicos de estos mamíferos voladores y cómo estos rasgos pueden empoderar a los murciélagos para actuar como reservorios excepcionales4,6,66,67,68. Algunas explicaciones putativas para el potencial del reservorio proponen que la variación inmune durante la hibernación69 o las temperaturas más altas que experimentan los murciélagos durante el vuelo (en la hipótesis de la ‘fiebre’70) disminuyan las cargas virales y, por lo tanto, mantengan su estado como reservorio viral. Sin embargo, los estudios en células de murciélago cultivadas a altas temperaturas no muestran una disminución en los títulos virales en comparación con las células cultivadas a 37 oC71. Además, estas hipótesis han perdido tracción recientemente, ya que más estudios indican una tolerancia a la infección por virus en lugar de una reducción activa de la carga viral. Los trabajos recientes sobre el metabolismo de los murciélagos, la dinámica mitocondrial, la inmunidad innata y adaptativa y los vínculos entre los sistemas metabólico e inmune han proporcionado información sobre las posibles respuestas dinámicas en los murciélagos. Lo que hace que los murciélagos sean especiales podría no ser su capacidad antiviral, sino más bien sus características antidesal72,73,74. Aquí hipotetes que el equilibrio único entre la defensa del huésped y la tolerancia inmune en los murciélagos puede ser responsable de la relación especial entre los murciélagos y los virus (particularmente los coronavirus).
Un sistema equilibrado de tolerancia-defensa del anfitrión
La homeostasis es el estado último de salud para cualquier sistema vivo, desde las células hasta los cuerpos humanos, y la obtención de homeostasis requiere el ajuste constante de las vías bioquímicas y fisiológicas. Por ejemplo, el mantenimiento de una presión arterial constante resulta de ajustes finos y equilibrio de muchas funciones coordinadas que incluyen sistemas hormonales, neuromusculares y cardiovasculares. Esto también es cierto para un sistema de defensa de acogida eficaz. Aunque se requiere un nivel adecuado de defensa para combatir patógenos y enfermedades, las respuestas excesivas o desreguladas conducen a daño celular y patología tisular. Muchos virus emergentes transmitidos por murciélagos, incluidos el SARS-CoV y el virus del Ebola, son altamente patógenos en los seres humanos, lo que se correlaciona con una activación inmunitaria innata aberrante con respuestas inmunitarias prolongadas y/o más fuertes75,76,77,78. Por el contrario, los murciélagos infectados no muestran signos mínimos de enfermedad, incluso cuando se detectan títulos víricos altos en tejidos o sueros, lo que sugiere que son tolerantes a las enfermedades virales79,80,81,82. Estudios recientes han proporcionado información sobre los mecanismos utilizados por los murciélagos para afinar un equilibrio entre las respuestas protectoras frente a las patológicas, lo que puede contribuir a su extraordinaria vida útil larga y a su baja incidencia de cáncer (Fig. 2).
2: El equilibrio único entre la defensa del huésped y la tolerancia inmune en los murciélagos.
Los murciélagos muestran un excelente equilibrio entre las respuestas mejoradas de la defensa del huésped y la tolerancia inmune a través de varios mecanismos. Ejemplos de defensas mejoradas del huésped incluyen la expresión constitutiva de IFN y genes estimulados por interferón (ISG), una mayor expresión de proteínas de choque térmico (HSP), una expresión de nivel base más alto de la bomba de eflujo ABCB1 y una mayor autofagia. Por otro lado, el STING amortiguado y las vías inflamósticas suprimidas, como la NLRP3 amortiguada, la pérdida de PYHIN y la IL-1 aguas abajo, contribuyen a la tolerancia inmunitaria en los murciélagos.
Respuestas mejoradas de la defensa del anfitrión
El estatus único de los murciélagos como reservorio viral ha desencadenado un creciente interés y esfuerzos para caracterizar el sistema inmunológico de los murciélagos. Los esfuerzos anteriores se centraron en la73,83 y análisis transcriptómico84,85,86, y en particular sobre las actividades de interferón y antivirales87,88,89,90. Los seres humanos expresan niveles basales mínimos de interferones de tipo I (IFN), y son altamente inducibles tras la estimulación91. En comparación, el zorro volador negro (Pteropus alecto) expresa constitutivamente algún IFN basal, y muchas especies de murciélagos expresan varios genes estimulados por IFN antes de la estimulación84,89,92,93. Esto puede ser regulado por factores reguladores de la IFN (FRF), como patrones de expresión diferencial de IRF794 y respuestas antivirales mediadas por IRF3 mejoradas95 se observan en murciélagos. La inducción restringida de IFN de tipo I minimizaría la producción de citoquinas inflamatorias93. La cinética de la respuesta IFN en murciélagos también difiere de la de otros mamíferos, con una fase de declive más rápida para algunos genes estimulados por el interferón de murciélago88. Además, varios genes antivirales, como el RNASEL88,90—son inducidos por IFN en murciélagos, pero no en otros mamíferos84,93 o han sufrido presión de selección para alterar potencialmente la función, como las que codifican las proteínas Mx96 y APOBEC397. La activación inmune antiviral en murciélagos también ha sido revisada previamente98,99. Así como la señalización IFN varía según los mamíferos100, también hay variación en la respuesta IFN entre las especies de murciélagos. Por ejemplo, P. alecto muestra una contracción de un locus ifn89, mientras que el murciélago de frutas egipcio (Rousettus aegyptiacus) no exhibe un IFN constitutivo, pero tiene un locus IFN marcadamente expandido, especialmente para IFN73. Varias especies sugieren un perfil de inducción restringido de IFN y IFN en comparación con el ser humano o el ratón84,92,93. La desregulación de la respuesta de la IFN se ha visto implicada previamente en enfermedades autoinmunes101 y la patogénesis de varios virus transmitidos por murciélagos, incluido el virus del Ebola76SARS-CoV75,76,77 y SARS-CoV-2102,103. Juntos, estos cambios específicos de murciélagos en la expresión basal, cinética, inducción o funciones de genes antivirales en la señalización IFN podrían ayudar a los murciélagos a controlar eficientemente los numerosos virus que albergan.
Además de las respuestas inmunitarias innatas, estudios recientes han arrojado luz sobre otros mecanismos de defensa de los anfitriones de murciélagos. La autofagia mejorada tiene un papel clave en el aumento del aclaramiento del lyssavirus de las células batales104, y se sabe que regula la inmunidad y media el aclaramiento de patógenos105. Los murciélagos expresan niveles muy altos de proteínas de choque térmico, lo que confiere a las células de los murciélagos la capacidad de sobrevivir a alta temperatura y alto estrés oxidativo in vitro. Las proteínas de choque térmico contribuyen a la rápida aceleración de la evolución viral mediante el chaperoning de proteínas virales y tolerando algunas mutaciones virales106. También actúan como un receptor viral107, regular la inflamación108, bloquear la apoptosis109 y afectan el envejecimiento110.
Común a todos los murciélagos aún examinados, los genes de fosforilación oxidativa mitocondrial y nuclear muestran evidencia de cambios evolutivos adaptativos específicos que apoyan las grandes demandas metabólicas asociadas con el vuelo99,111. Los murciélagos también tienen una concentración de genes seleccionados positivamente en las vías de control de daño del ADN que son importantes para la muerte celular, el cáncer y el envejecimiento, además de las vías inmunitarias innatas83. Un estudio reciente ha demostrado que el eflujo farmacológico eficiente a través del transportador ABCB1 en murciélagos bloqueó el daño del ADN inducido por los fármacos quimioterápicos doxorubicina y etopósido, confiriendo resistencia a compuestos genotóxicos, regulando la homeostasis celular y posiblemente reduciendo la incidencia de cáncer112. Los murciélagos tienen una producción reducida de especies reactivas de oxígeno en comparación con mamíferos no voladores de tamaño similar, pero conservan intacta la actividad del importante superóxido antioxidante dismutasa113,114. Estos hallazgos sugieren una eliminación más eficaz de especies reactivas de oxígeno o una menor producción de especies reactivas de oxígeno por mitocondrias de murciélagos: un estudio reciente ha confirmado la disminución de la generación de especies reactivas de oxígeno en los murciélagos, sin la disminución dependiente de la edad de la defensa de las especies de oxígeno antirreactivo observada en ratones115.
Mecanismos de tolerancia inmune
Tanto los murciélagos infectados naturalmente como los infectados experimentalmente indican la tolerancia a la infección viral, incluso durante una fase transitoria de títulos virales altos79,80,81,82. Por ejemplo, la infección de murciélagos con altas dosis de virus del Ebola79 y MERS-CoV81 enfermedad clínica mínima o nula, aunque los títulos pueden llegar hasta 107 unidades fluorescentes de formación de focos por mililitro de sueros para el virus del Ebola y 107 mediana de la dosis infecciosa de cultivo tisular (reducción del 50%) equivalentes por gramo de tejidos pulmonares para mers-coV. Esto apoya una tolerancia inmunológica a los virus del ARN en los murciélagos, particularmente durante la respuesta aguda. Estas observaciones han desencadenado crecientes esfuerzos para estudiar cómo los murciélagos limitan las respuestas inmunes inmunes excesivas o aberrantes. Desde la caracterización inicial de dos genomas de murciélagos divergentes83 y a través de adiciones más recientes del genoma73,116,117, se ha revelado una tendencia constante para la evolución de los genes relacionados con el sistema inmunitario, incluidos los que codifican los receptores de reconocimiento de patrones. Los receptores de reconocimiento de patrones detectan moléculas endógenas a partir de células dañadas y estructuras microbianas estructuralmente conservadas, conocidas como patrones moleculares asociados al daño y a los patógenos, respectivamente118. El reconocimiento de la invasión viral por estos receptores de reconocimiento de patrones y su señalización aguas abajo son defensas clave de primera línea119. El primer estudio mecanicista de la tolerancia inmune en los murciélagos mostró que la respuesta IFN de tipo I dependiente de STING se amortiguaba en varias especies de murciélagos, y que esto resulta de una mutación puntual de un residuo altamente conservado de STING87. STING es un importante receptor de reconocimiento de patrones que media la señalización inducida por ADN citosólico y tiene un papel clave en la infección, la inflamación y el cáncer120. Esta mutación podría ser impulsada evolutivamente a tolerar la sobreactivación de STING por daño de ADN del huésped que es inducido por el vuelo. Sin embargo, el efecto de la picadura amortiguada en las respuestas a la infección por virus de ARN transmitidos por murciélagos, que podrían activar la picadura induciendo daño al ADN del huésped121—aún no se ha entendido.
Un estudio más reciente ha revelado un mecanismo clave por el cual los murciélagos amortiguan naturalmente la inflamación del huésped en respuesta a señales de peligro «estériles» e infecciones con tres tipos de virus de ARN (incluyendo MERS-CoV)72. El dominio de pirín de la familia NLR que contiene 3 (NLRP3), un sensor inflamasoma clave que reconoce diversas tensiones celulares e invasiones de patógenos, se amortigua tanto a nivel de transcripción como de proteína en los murciélagos. Es importante destacar que las respuestas inflamatorias mediadas por NLRP3 reducidas a los virus del ARN no tienen, o son mínimas, efectos sobre las cargas virales. Esto apoya una mayor tolerancia inmune innata en los murciélagos, que es consistente con su estado único como un reservorio viral asintomático. Como NLRP3 es cada vez más reconocido como la detección de una amplia gama de virus emergentes122 (incluyendo MERS-CoV72 y SARS-CoV123,124), este mecanismo puede tener una amplia aplicación en la gran variedad de virus transmitidos por murciélagos (incluido SARS-CoV-2)125,126. Además de NLRP3, un estudio anterior informó de la pérdida única de toda la familia del gen PYHIN a nivel genómico en los murciélagos127. Los miembros de la familia del gen PYHIN (también conocidos como receptores similares a AIM2) incluyendo AIM2 e IFI16 son reconocidos como los únicos sensores inflammatos para el ADN intracelular, tanto de origen microbiano como microbiano128. Tanto NLRP3 como AIM2 convergen en su caspasa-1 efector descendente, que es responsable de la escisión de las citoquinas inflamatorias IL-1o e IL-18, y al mismo tiempo desata la muerte celular inflamatoria (piroptosis) a través de GSDMD129,130. Los datos recientes revelan mecanismos adicionales de amortiguación a nivel de caspasa-1 y IL-1 aguas abajo131, demostrando una focalización única de la vía inflammasoma para la inhibición en los murciélagos. Las altas demandas metabólicas de vuelo podrían, en teoría, conducir a la liberación de subproductos metabólicos, incluyendo especies reactivas de oxígeno, ATP, ADN dañado y otras señales de peligro que se sabe que desencadenan la activación inflamasoma. Por lo tanto, las adaptaciones al vuelo podrían haber impulsado los diferentes mecanismos de amortiguación en los murciélagos, lo que a su vez limita la excesiva inflamación inducida por el virus o relacionada con la edad: esto podría contribuir posteriormente a la tolerancia de la infección viral y al aumento de la vida útil de los murciélagos.
Otros estudios han proporcionado más información sobre la tolerancia inmune de los murciélagos, aunque estos carecen de validación funcional o examen en varias especies de murciélagos. El tratamiento con ácido poliinosinico: ácido policitocílico, un ligando de ARN de doble cadena, en las células del gran murciélago marrón (Eptesicus fuscus) no provocó una inducción robusta de TNF, debido a un motivo c-Rel en la región promotora132. Sin embargo, esto podría ser una observación específica de la especie y/o ligando específica, ya que este motivo no se detecta en la región promotora de TNF de P. alecto y la producción de TNF se observó con otros ligandos72. Un estado inmune inhibitorio de las células asesinas naturales se ha inferido del análisis del genoma de los receptores de células asesinas naturales, proporcionando apoyo para una mayor tolerancia inmune73. En un modelo de chimaera de murciélago-ratón, un ratón inmunodeficient reconstituido con un sistema inmune de murciélago parecía ser menos propenso a la enfermedad de injerto contra huésped que otros sistemas de ratón quimérico reconstituidos con células inmunitarias de donantes de animales humanos y otros mamíferos133. Aunque los mecanismos detallados de tolerancia inmunitaria aún no han sido aclarados, la observación es consistente con otros descubrimientos relacionados con murciélagos que tienen un sistema de defensa-tolerancia que es más equilibrado de lo típico entre los mamíferos.
En resumen, las respuestas generales mejoradas de defensa del huésped, junto con la tolerancia o amortiguación inmunes, parecen proporcionar un equilibrio estricto en la forma en que los murciélagos responden a las tensiones, lo que se demuestra elegantemente en sus respuestas a las infecciones virales. Además, estudios evolutivos han revelado varios genes o vías que están bajo fuerte selección positiva en murciélagos, que requieren una investigación funcional adicional. Estos incluyen los receptores similares a los peajes de detección de ácido nucleico (otro grupo de receptores de reconocimiento de patrones), que podrían reflejar la detección alterada de patógenos134. Hay evidencia de evolución adaptativa en las vías de murciélago cGAS–STING y OEA-RNase L, que potencialmente alteran la capacidad de los murciélagos para activar ifN en respuesta a ácidos nucleicos celulares87,135. Pteropus alecto Las moléculas MHC-I exhiben una isoforma única con una inserción de tres aminoácidos dentro de su ranura de unión a péptidos que conduce a motivos de unión a péptidos distintos con una preferencia por la prolina en el sitio de P136. Esta preferencia única de unión a péptidos no es responsable de la capacidad de P. alecto MHC-I para acomodar péptidos extendidos N-terminalmente de hasta 15-mers137. Otras especies de murciélagos muestran una inserción similar de tres o cinco aminoácidos, una característica que no es compartida por la mayoría de los otros mamíferos y que puede conferir inmunidad ventajosa a los células T136,138,139. Aunque la caracterización genómica y los estudios evolutivos de los genes bat MHC-II han sido descritos previamente, se requiere una investigación de laboratorio adicional para evaluar cualquier diferencia funcional con respecto a las de otros mamíferos140,141.
Aprender de los murciélagos
La investigación en murciélagos y virus de las últimas décadas ha fortalecido la noción de que los murciélagos son de hecho «especiales» como reservorios para virus emergentes. La siguiente pregunta importante gira en torno a discernir lo que hace que los murciélagos sean especiales. El equilibrio único de las respuestas mejoradas de defensa del huésped y la tolerancia inmunitaria a través de varios mecanismos podría ser la clave de esta pregunta. Una comprensión más profunda proporcionará ideas y estrategias no sólo para ayudar en la predicción, prevención o control de la propagación del virus zoonótico de los murciélagos a los seres humanos, sino también para combatir potencialmente el envejecimiento y el cáncer en los seres humanos. Además, el efecto de la inmunidad alterada de los murciélagos en la evolución viral puede causar una mayor virulencia después de la propagación en huéspedes con sistemas inmunitarios divergentes142. Uno de los hallazgos clave que se ha destacado anteriormente es la activación amortiguada del complejo inflamable en murciélagos. Estudios anteriores han demostrado una activación inflammasó alterada en los murciélagos, incluida la pérdida de la familia del gen PYHIN127, NLRP3 amortiguado72 y la función reducida de la caspasa-1 y/o IL-1131 (Fig. 3). Es importante destacar que la amplitud de las enfermedades impulsadas por inflamammas en los seres humanos es notable, y a menudo implica la activación excesiva de esta vía. Estas enfermedades incluyen, entre otras, enfermedades autoinmunes y autoinflamatorias, enfermedades infecciosas y varias enfermedades relacionadas con la edad (como enfermedades metabólicas y neurodegenerativas)143. Los estudios mecánicos de tolerancia inmune pueden revelar factores reguladores clave para el desarrollo de dianas y estrategias para limitar las respuestas inflamatorias dañinas en los seres humanos. Una comparación genómica de genes relacionados con el sistema inmunitario revela que la relación filogenética entre los murciélagos y los seres humanos es más cercana que la que existe entre los humanos y los roedores144. Esta mayor similitud consolida los murciélagos como potencialmente representando especies modelo poderosas para el estudio de enfermedades virales, envejecimiento y cáncer, promoviendo la traducción de los hallazgos en murciélagos en tratamientos clínicamente relevantes.
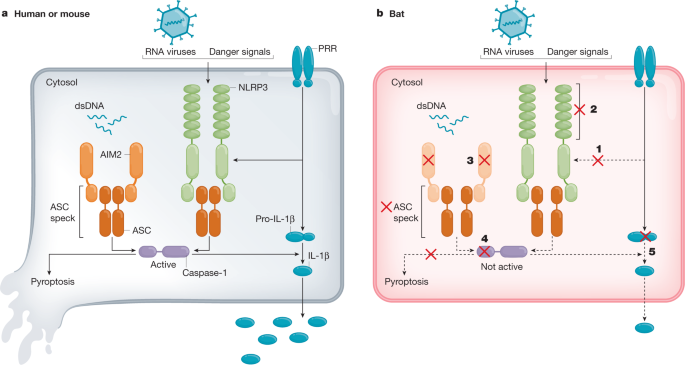
3: Esquema de los mecanismos multinivel de la activación inflammasa amortiguada en murciélagos.
a, En humano o ratón, el cebado del receptor de reconocimiento de patrones (PRR) y la posterior activación por virus de ARN, señales de peligro o ADN intracelular de doble cadena activan el inflammasoma NLRP3 o AIM2 con la formación intacta de manchas ASC, pirtosis y secreción de IL-1. b, Por el contrario, los murciélagos han amortiguado el cebado transcripcional (1) y reducido la función proteica (2) para NLRP3, la pérdida de PYHIN incluyendo AIM2 (3), y la reducción de la actividad de la caspasa-1 (4) y/o el escot de IL-1 (5), lo que conduce a una reducción general de la inflamación.
Uno de los principales desafíos para estudiar la biología de los murciélagos y la inmunología es que, como todavía no son especies modelo, hay herramientas y reactivos limitados para los murciélagos. Los esfuerzos recientes para caracterizar el sistema inmunitario de los murciélagos han dado lugar a desarrollos de herramientas de investigación más específicas para los murciélagos, incluidos los anticuerpos para los marcadores de células inmunitarias144,145 y protocolos para la diferenciación de las células inmunitarias primarias146. Además, los nuevos modelos animales in vivo incluyen un modelo de chimaera murciélago-ratón133 y modelos transgénicos o de ratón que contienen un gen del murciélago. Varios grupos de investigación ahora también tienen colonias de murciélagos cautivos. Estos son invaluables en la investigación de los mecanismos de defensa o tolerancia del anfitrión y facilitar la traducción de las lecciones de los murciélagos. Con el establecimiento de más reactivos y herramientas para los murciélagos, estamos seguros de que una comprensión más profunda de lo que hace que los murciélagos sean especiales proporcionará ideas y estrategias para combatir la infección, el envejecimiento y otras enfermedades inflamatorias en los seres humanos.
Conclusiones
Hace unas décadas, nadie habría predicho que la investigación de murciélagos ganaría el impulso que tiene ahora. Además del vuelo, varios rasgos biológicos hacen que los murciélagos sean únicos entre los mamíferos. Endeavours como los del consorcio Bat1K147, y tecnologías como la secuenciación de ARN de una sola célula, permitirán la caracterización imparcial y más profunda de los murciélagos, las poblaciones de células inmunitarias de murciélagos y sus funciones y vías específicas. El equilibrio entre la defensa del huésped y la tolerancia inmune de los murciélagos confiere una salud excepcional. La identificación de los reguladores y maquinarias clave que intervienen en el mantenimiento de este equilibrio homeostático proporcionaría valiosas lecciones para el control y la lucha contra los virus, el cáncer, el envejecimiento y numerosas enfermedades inflamatorias en los seres humanos. Los virus no reconocen los bordes, ni tampoco los murciélagos. Se necesita una mayor concienciación sobre la investigación de murciélagos en consonancia con los resultados traslacionales para los seres humanos y la solidaridad internacional en los esfuerzos de investigación de laboratorio y de campo. Al comprender la fuente de virus emergentes y aprovechar el conocimiento de la naturaleza, podemos desarrollar enfoques para mejorar el estado mundial de One Health148.
Referencias
- 1.
Quién. COVID-19 Informe de situación https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports (consultado el 21 de diciembre de 2020).
- 2.
Andersen, K. G., Rambaut, A., Lipkin, W. I., Holmes, E.C. & Garry, R. F. El origen proximal del SARS-CoV-2. Nat. Med. 26, 450–452 (2020).
- 3.
Zhou, P. et al. Un brote de neumonía asociado con un nuevo coronavirus de probable origen murciélago. Naturaleza 579, 270–273 (2020). Este documento de virología clave detalla el aislamiento y la caracterización del virus SARS-CoV-2 responsable del brote actual de COVID-19 y de un murciélago COV estrechamente relacionado.
- 4.
Calisher, C. H., Childs, J. E., Field, H. E., Holmes, K. V. & Schountz, T. Bats: importantes reservorios de virus emergentes. Clin. La microbiol. Rev. 19, 531–545 (2006). La primera revisión exhaustiva de los murciélagos como una fuente única de reservorios de virus emergentes, que proporciona un resumen que sigue siendo muy citado y relevante para el día de hoy.
- 5.
Smith, I. & Wang, L. F. Bats y su viromo: una importante fuente de virus emergentes capaces de infectar a los humanos. Curr. Opin. Virol. 3, 84–91 (2013).
- 6.
Wang, L. F. & Anderson, D. E. Virus en murciélagos y posibles derrames a animales y humanos. Curr. Opin. Virol. 34, 79–89 (2019).
- 7.
Enright, J.B., Sadler, W. W., Moulton, J. E. & Constantine, D. Aislamiento del virus de la rabia de un murciélago insectívoro (Tadarida mexicana) en California. Proc. 89, 94–96 (1955).
- 8.
Goldstein, T. et al. El descubrimiento del virus Bombali añade más apoyo a los murciélagos como huéspedes de los ebolavirus. Microbiol . 3, 1084-1089 (2018).
- 9.
Mollentze, N. & Streicker, D. G. El riesgo zoonótico viral es homogéneo entre las órdenes taxonómicas de los reservorios de mamíferos y aviar. Nosotros.
- 10.
Simmons, N.B. & Cirranello, A. L. Bat Species of the World: A Taxonomic and Geographic Database https://batnames.org/ (consultado el 12 de agosto de 2020).
- 11.
Mammal Diversity Database version 1.2 https://doi.org/10.5281/zenodo.4139818 (2020).
- 12.
Nowak, R.M. & Walker, E. P. Walker’s Bats of the World (Johns Hopkins Univ. Press, 1994).
- 13.
Jones, K. E. (ed.) en Encyclopedia of Life Sciences https://doi.org/10.1038/npg.els.0004129 (Wiley, 2006).
- 14.
Voigt, C.C. & Kingston, T. Bats in the Anthropocene (Springer International, 2015).
- 15.
Kunz, T. H. Ecología de los murciélagos (Springer US, 1982).
- 16.
Geiser, F. & Stawski, C. Hibernación y torpor en murciélagos tropicales y subtropicales en relación con la energía, extinciones y la evolución de la endotermia. Integr. Biol. 51, 337–348 (2011).
- 17.
Jones, G. & Holderied, M. W. Bat echolocation llama: adaptación y evolución convergente. Proc. R. Soc. B 274, 905–912 (2007).
- 18.
Springer, M. S., Teeling, E.C., Madsen, O., Stanhope, M. J. & de Jong, W. W. Nosotros. UU. 98, 6241–6246 (2001).
- 19.
Wang, Y., Pan, Y., Parsons, S., Walker, M. & Zhang, S. Bats responden a la polaridad de un campo magnético. Proc. R. Soc. B 274, 2901–2905 (2007).
- 20.
Alexander, R.M. Los méritos e implicaciones de viajar nadando, volando y corriendo para animales de diferentes tamaños. Integr. Biol. 42, 1060–1064 (2002).
- 21.
Thomas, S. P. Metabolismo durante el vuelo en dos especies de murciélagos, Phyllostomus hastatus y Pteropus gouldii. J. Exp. Biol. 63, 273–293 (1975).
- 22.
Voigt, C.C. & Speakman, J. R. Los murciélagos que alimentan Nectar alimentan su alto metabolismo directamente con carbohidratos exógenos. Funct. Ecol. 21, 913–921 (2007).
- 23.
Kelm, D. H., Simon, R., Kuhlow, D., Voigt, C.C. & Ristow, M. La alta actividad permite la vida en una dieta alta en azúcar: regulación de la glucosa en sangre en murciélagos que se alimentan de néctar. Proc. R. Soc. B 278, 3490–3496 (2011).
- 24.
O’Mara, M. T. et al. Los episodios cíclicos de bradicardia extrema contrarrestan el alto metabolismo de los murciélagos frugívoros. eLife 6, e26686 (2017).
- 25.
Muijres, F. T. et al. El vórtice de vanguardia mejora la elevación en murciélagos de vuelo lento. Ciencia 319, 1250–1253 (2008).
- 26.
Austad, S. N. & Fischer, K. E. Envejecimiento de mamíferos, metabolismo y ecología: evidencia de los murciélagos y marsupiales. J. Gerontol. 46, B47–B53 (1991).
- 27.
Podlutsky, A. J., Khritankov, A.M., Ovodov, N. D. & Austad, S. N. Un nuevo récord de campo para la longevidad del murciélago. J. Gerontol. A 60, 1366-1368 (2005).
- 28.
Austad, S. N. Methusaleh’s Zoo: cómo la naturaleza nos proporciona pistas para extender la salud humana. J. Comp. Pathol. 142, S10–S21 (2010).
- 29.
Wilkinson, G. S. & South, J.M. Historia de la vida, ecología y longevidad en murciélagos. Celda envejecida 1, 124–131 (2002).
- 30.
Metchnikoff, E., Weinberg, M., Pozerski, E., Distaso, A. & Berthelot, A. Rousettes et microbras. Pasteur (París) 23, 61(1909).
- 31.
Ictv. Https://talk.ictvonline.org/taxonomy de taxonomía de virus (a la que se accede el 21 de mayo de 2020).
- 32.
Lau, S. K. et al. Virus grave similar al coronavirus del síndrome respiratorio agudo en murciélagos de herradura chinos. Nosotros. UU. 102, 14040-14045 (2005). Un artículo muy citado en el campo que reveló murciélagos como el reservorio natural de coronavirus relacionados con el SRAS, que abrió una era de investigación sobre murciélagos y coronavirus.
- 33.
Ge, X. Y. et al. Aislamiento y caracterización de un coronavirus similar al SARS de murciélago que utiliza el receptor ACE2. Naturaleza 503, 535–538 (2013). Producto de diez años de investigación intensiva, este estudio confirmó la presencia de SARS-CoV en los murciélagos y su potencial para infectar a los seres humanos, lo que es de relevancia contemporánea para la búsqueda actual de los orígenes del SARS-CoV-2.
- 34.
Li, W. et al. Los murciélagos son reservorios naturales de coronavirus similares al SARS. Ciencia 310, 676–679 (2005).
- 35.
Poon, L. L. et al. Identificación de un nuevo coronavirus en murciélagos. J. Virol. 79, 2001-2009 (2005).
- 36.
Banerjee, A., Kulcsar, K., Misra, V., Frieman, M. & Mossman, K. Murciélagos y coronavirus. Virus 11, 41 (2019).
- 37.
Woo, P.C. Y., Lau, S. K. P., Li, K. S.M., Tsang, A. K. L. & Yuen, K. Y. Relación genética del grupo humano nuevo C betronavirus a Tylonycteris corona batvirus HKU4 y Pipistrellus bat coronavirus HKU5. Emergente. Microbios Infectan. 1, e35 (2012).
- 38.
Cui, J., Li, F. & Shi, Z. L. Origen y evolución de coronavirus patógenos. Microbiol. 17, 181–192 (2019).
- 39.
Fan, Y., Zhao, K., Shi, Z. L. & Zhou, P. Bat coronavirus en China. Virus 11, 210 (2019).
- 40.
Hu, B. et al. El descubrimiento de un rico grupo genético de coronavirus relacionados con el SARS de murciélagos proporciona nuevos conocimientos sobre el origen del coronavirus del SRAS. PLoS Pathog. 13, e1006698 (2017).
- 41.
Zhou, H. et al. Un nuevo coronavirus murciélago relacionado estrechamente con SARS-CoV-2 contiene inserciones naturales en el sitio de escisión S1/S2 de la proteína spike. Curr. Biol. 30, 2196–2203.e3 (2020).
- 42.
Cheng, V.C., Lau, S. K., Woo, P.C. & Yuen, K. Y. Coronavirus del síndrome respiratorio agudo grave como agente de infección emergente y reemerante. Clin. La microbiol. Rev. 20, 660–694 (2007).
- 43.
Latinne, A. et al. Transmisión de origen y especies de coronavirus de murciélagos en China. Nat. Commun. 11, 4235 (2020).
- 44.
Cima, G. Programa de prevención de pandemias que termina después de 10 años. JAVMAnews https://www.avma.org/javma-news/2020-01-15/pandemic-prevention-program-ending-after-10-years (2 de enero de 2020).
- 45.
Wadman, M. & Cohen, el axing de coronavirus de murciélagos de J. NIH otorga un «precedente horrible» y podría romper las reglas, dicen los críticos. Science https://doi.org/10.1126/science.abc5616 (30 de abril de 2020).
- 46.
Murray, K. et al. Un morbillivirus que causó enfermedades mortales en caballos y humanos. Ciencia 268,94–97 (1995).
- 47.
Chua, K.B. et al. Virus Nipah: un paramyxovirus mortal recientemente emergente. Ciencia 288, 1432–1435 (2000).
- 48.
Zhou, P. et al. Síndrome de diarrea aguda porcina mortal causado por un coronavirus relacionado con la HKU2 de origen murciélago. Naturaleza 556, 255–258 (2018).
- 49.
Huang, Y. W. et al. Origen, evolución y genotipado de cepas emergentes del virus de la diarrea por epidemia porcina en los Estados Unidos. MBio 4, e00737-13 (2013).
- 50.
SARS-CoV-2 infection in farmed minks, Netherlands, april and May 2020. EuroSurveill. 25, 2001005 (2020).
- 51.
Evidencia.M de infección por SARS-CoV-2 de huéspedes animales. Patógenos 9, 529 (2020).
- 52.
Sit, T.H.C. et al. Infección de perros con SARS-CoV-2. Naturaleza 586, 776-778 (2020).
- 53.
Newman, A. et al. Primeros casos notificados de infección por SARS-CoV-2 en animales de compañía – Nueva York, marzo-abril 2020. MMWR Morb. Mortal. Wkly. Rep. 69, 710–713 (2020).
- 54.
Gillespie, T. R. & Leendertz, F. H. COVID-19: proteger a los grandes simios durante las pandemias humanas. Naturaleza 579, 497 (2020).
- 55.
Olival, K. J. et al. Posibilidad de transmisión zoonótica inversa de SARS-CoV-2 a la fauna libre: un caso de estudio de murciélagos. PLoS Pathog. 16, e1008758 (2020).
- 56.
Xiao, Y. et al. Cambios patológicos en los civets de palma enmascarados infectados experimentalmente por el coronavirus del síndrome respiratorio agudo grave (SARS). J. Comp. Pathol. 138, 171–179 (2008).
- 57.
Lam, T. T. et al. Identificación de coronavirus relacionados con SARS-CoV-2 en pangolines malayos. Naturaleza 583, 282–285 (2020).
- 58.
Xiao, K. et al. Aislamiento de coronavirus relacionados con SARS-CoV-2 de pangolines malayos. Naturaleza 583, 286–289 (2020).
- 59.
Cogswell-Hawkinson, A. et al. El virus de Tacaribe causa una infección fatal de un huésped del reservorio ostensible, el murciélago de frutas jamaiquino. J. Virol. 86, 5791–5799 (2012).
- 60.
Freuling, C. et al. Infección experimental de murciélagos serotinos (Eptesicus serotinus) con lyssavirus de murciélago europeo tipo 1a. J. Gen. 90, 2493–2502 (2009).
- 61.
Negredo, A. et al. Descubrimiento de un filovirus similar al ébola en Europa. PLoS Pathog. 7, e1002304 (2011).
- 62.
Frick, W. F., Puechmaille, S. J. & Willis, C. K. R. in Bats in the Anthropocene: Conservation of Bats in a Changing World (eds Voigt, C. & Kingston, T.) 245–262 (Springer, 2015).
- 63.
Luis, A.D. et al. Una comparación de murciélagos y roedores como reservorios de virus zoonóticos: ¿son especiales los murciélagos? Proc. R. Soc. B 280, 20122753 (2013).
- 64.
Brook, C. E. & Dobson, A. P. Bats como reservorios «especiales» para patógenos zoonóticos emergentes. Tendencias Microbiol. 23, 172–180 (2015).
- 65.
Olival, K. J. et al. Los rasgos del huésped y los rasgos virales predicen la propagación zoonótica de los mamíferos. Naturaleza 546, 646–650 (2017). Un estudio histórico que utilizó rasgos del huésped (como factores ambientales, taxonomía anfitriona y presencia humana dentro del rango de una especie anfitriona) para demostrar que, de todas las órdenes de mamíferos, los murciélagos contienen la mayor proporción de virus zoonóticos.
- 66.
Wang, L.-F., Walker, P. J. & Poon, L. L. Extinciones masivas, biodiversidad y función mitocondrial: ¿son los murciélagos ‘especiales’ como reservorios para virus emergentes? Curr. Opin. Virol. 1, 649–657 (2011).
- 67.
Plowright, R. K. et al. Dinámica ecológica de la propagación del virus de los murciélagos emergentes. Proc. R. Soc. B 282, 20142124 (2015). Una revisión exhaustiva que analiza una variedad de factores ecológicos de contagio zoonótico y posibles factores de riesgo.
- 68.
Han, H. J. et al. Bats as reservoirs of severe emerging infectious diseases. Virus Res. 205, 1–6 (2015).
- 69.
Bouma, H. R., Carey, H. V. & Kroese, F. G. Hibernation: the immune system at rest? J. Leukoc. Biol. 88, 619–624 (2010).
- 70.
O’Shea, T. J. et al. Bat flight and zoonotic viruses. Emerg. Infect. Dis. 20, 741–745 (2014).
- 71.
Miller, M. R. et al. Broad and temperature independent replication potential of filoviruses on cells derived from Old and New World bat species. J. Infect. Dis. 214, S297–S302 (2016).
- 72.
Ahn, M. et al. Dampened NLRP3-mediated inflammation in bats and implications for a special viral reservoir host. Nat. Microbiol. 4, 789–799 (2019). A functional study that demonstrates lowered activation of the NLRP3 inflammasome sensor in bats with a reduced response to both ‘sterile’ and zoonotic viral infection, mechanistically identifying dampened transcriptional priming, a novel splice variant and functional activity of bat NLRP3.
- 73.
Pavlovich, S. S. et al. The Egyptian rousette genome reveals unexpected features of bat antiviral immunity. Cell 173, 1098–1110 (2018).An important bat genomics paper that reveals potential mechanisms of host tolerance.
- 74.
Hayman, D.T.S. Tolerancia al murciélago a las infecciones virales. Microbiol . 4, 728–729 (2019).
- 75.
Cameron, M. J., Bermejo-Martin, J. F., Danesh, A., Muller, M. P. & Kelvin, D. J. Inmunopathogénesis humana del síndrome respiratorio agudo grave (SARS). Virus Res. 133, 13–19 (2008).
- 76.
Liu, X. et al. Las firmas transcriptómicas diferencian la supervivencia de los desenlace fatales en seres humanos infectados con el virus del Ebola. Genoma Biol. 18, 4 (2017).
- 77.
Totura, A. L. & Baric, R. S. SRAS patogénesis coronavirus: respuestas inmunitarias innatas del huésped y antagonismo viral del interferón. Curr. Opin. Virol. 2, 264–275 (2012).
- 78.
Zampieri, C. A., Sullivan, N. J. & Nabel, G. J. Inmunopatología de patógenos altamente virulentos: ideas del virus del Ebola. Nat. Immunol. 8, 1159–1164 (2007).
- 79.
Swanepoel, R. et al. Inoculación experimental de plantas y animales con virus del Ebola. Emergente. Infecta. Dis. 2, 321–325 (1996).
- 80.
Watanabe, S. et al. Coronavirus murciélagos e infección experimental de murciélagos, Filipinas. Emergente. Infecta. Dis. 16, 1217–1223 (2010).
- 81.
Munster, V. J. et al. Replicación y desprendimiento del MERS-CoV en murciélagos frutales jamaiquinos (Artibeus jamaicensis). Sci. Rep. 6, 21878 (2016).
- 82.
Experimental Nipah virus infection in pteropid bats (Pteropus poliocephalus). J. Comp. Pathol. 136, 266–272 (2007).
- 83.
Zhang, G. et al. El análisis comparativo de los genomas de murciélagos proporciona información sobre la evolución del vuelo y la inmunidad. Ciencia 339, 456–460 (2013). El primer estudio comparativo de genómica de murciélagos, que reveló varios genes altamente seleccionados, faltantes o alterados que tienen diversos roles en el daño del ADN de los mamíferos, vías inmunitarias y oxidativas de fosforilación innatas y abrió varias vías para nuevos descubrimientos en murciélagos.
- 84.
Glennon, N.B., Jabado, O., Lo, M. K. & Shaw, M. L. Transcriptome profiling de la respuesta inmune innata inducida por el virus en Pteropus vampyrus y su atenuación por las funciones antagonistas del interferón del virus Nipah. J. Virol. 89, 7550–7566 (2015).
- 85.
Wynne, J. W. et al. La proteómica informada por transcriptómica revela que el virus hendra sensibiliza las células de los murciélagos a la apoptosis mediada por TRAIL. Genoma Biol. 15, 532 (2014).
- 86.
Papenfuss, A. T. et al. El repertorio genético inmune de un importante reservorio viral, el zorro volador negro australiano. BMC Genomics 13, 261 (2012).
- 87.
Xie, J. et al. Activación de interferón dependiente del STING amortiguado en murciélagos. Cell Host Microbe 23, 297–301 (2018). Un importante estudio experimental que mostró una reducción de la señalización por el sensor intracelular, STING, de murciélagos, debido a un reemplazo —en todas las especies de murciélagos— de un residuo de serina (S358) que es altamente conservado en otros mamíferos; este reemplazo resulta en la pérdida de la producción de interferón y la actividad antiviral.
- 88.
De La Cruz-Rivera, P.C. et al. La respuesta IFN en murciélagos muestra cinética distintiva de expresión génica estimulada por IFN con inducción atípica de ARNSEL. J. Inmunol. 200,209-217 (2018).
- 89.
Zhou, P. et al. Contracción del locus IFN tipo I y expresión constitutiva inusual de IFN-α en murciélagos. Nosotros.
- 90.
Perfil de expresión génica dependiente de IFNAR2 inducido por IFN-α en células de murciélagos de Pteropus alecto e impacto del nocaut de IFNAR2 en la infección por virus. PLoS ONE 12, e0182866 (2017).
- 91.
McNab, F., Mayer-Barber, K., Sher, A., Wack, A. & O’Garra, A. Tipo I interferones en enfermedades infecciosas. Nat. 15, 87–103 (2015).
- 92.
Shaw, A.E. et al. Propiedades fundamentales del sistema inmune innato de mamíferos reveladas por comparación multiespecie de las respuestas de interferón de tipo I. PLoS Biol. 15, e2004086 (2017).
- 93.
Jalzer, M. et al. Transcriptomas de células inducidas por virus e interferón alfa del microbato Myotis daubentonii. iScience 19, 647–661 (2019).
- 94.
IRF7 en el zorro volador negro australiano, Pteropus alecto: evidencia de un patrón de expresión único y conservación funcional. PLoS ONE 9, e103875 (2014).
- 95.
Banerjee, A. et al. La selección positiva de un residuo de serina en el murciélago IRF3 confiere una mayor protección antiviral. iScience 23, 100958 (2020).
- 96.
Fuchs, J. et al. Evolución y especificidades antivirales de proteínas Mx inducidas por interferón de murciélagos contra el ébola, la gripe y otros virus del ARN. J. Virol. 91, e00361-17 (2017).
- 97.
Hayward, J. A. et al. Evolución diferencial de los factores de restricción antirretrovirales en los murciélagos pteropides, según lo revelado por la complejidad del gen APOBEC3. Evol. 35, 1626-1637 (2018).
- 98.
Banerjee, A. et al. Nuevos conocimientos sobre el sistema inmunitario de los murciélagos. Delante. Inmunol. 11, 26 (2020).
- 99.
Subudhi, S., Rapin, N. & Misra, V. Modulación del sistema inmune y persistencia viral en murciélagos: comprensión del contagio viral. Virus 11, 192 (2019).
- 100.
Secombes, C. J. & Zou, J. Evolución de interferones y receptores de interferón. Delante. Inmunol. 8, 209 (2017).
- 101.
Malireddi, R. K. & Kanneganti, T. D. Papel de los interferones de tipo I en la activación inflammasma, muerte celular y enfermedad durante la infección microbiana. Delante. celda. Infecta. Microbiol. 3, 77 (2013).
- 102.
Huang, C. et al. Características clínicas de pacientes infectados con coronavirus novedoso 2019 en Wuhan, China. Lancet 395,497–506 (2020).
- 103.
Tay, M. Z., Poh, C.M., Rénia, L., MacAry, P. A. & Ng, L. F. P. La trinidad de COVID-19: inmunidad, inflamación e intervención. Nat. 20, 363–374 (2020).
- 104.
Laing, E. D. et al. La autofagia mejorada contribuye a reducir la infección viral en las células negras del zorro volador. Virus 11, 260 (2019).
- 105.
Kuballa, P., Nolte, W.M., Castoreno, A.B. & Xavier, R. J. Autofagia y el sistema inmunológico. Annu. Immunol. 30, 611–646 (2012).
- 106.
Phillips, A.M. et al. La proteostasis del huésped modula la evolución de la gripe. eLife 6, e28652 (2017).
- 107.
Reyes-del Valle, J., Chávez-Salinas, S., Medina, F. & Del Angel, R.M. La proteína de choque térmico 90 y la proteína de choque térmico 70 son componentes del complejo receptor del virus del dengue en las células humanas. J. Virol. 79, 4557–4567 (2005).
- 108.
Srivastava, P. Roles de proteínas de choque térmico en inmunidad innata y adaptativa. Nat. 2, 185–194 (2002).
- 109.
Beere, H.M. et al. La proteína de choque térmico 70 inhibe la apoptosis al prevenir el reclutamiento de procaspasa-9 para el apoptosoma Apaf-1. Nat. Cell Biol. 2, 469–475 (2000).
- 110.
Singh, R. et al. Proteína de choque térmico 70 genes y longevidad humana: una vista de Dinamarca. Ann. NY Acad. Sci. 1067, 301–308 (2006).
- 111.
Shen, Y. Y. et al. Evolución adaptativa de los genes del metabolismo energético y el origen del vuelo en murciélagos. Nosotros. UU. 107, 8666–8671 (2010).
- 112.
ABCB1 protege las células de los murciélagos del daño del ADN inducido por compuestos genotóxicos. Nat. Commun. 10, 2820 (2019).
- 113.
Brunet-Rossinni, A. K. Reducción de la producción de radicales libres y longevidad extrema en el pequeño murciélago marrón (Myotis lucifugus) frente a dos mamíferos no voladores. Mech. Envejecimiento Dev. 125, 11–20 (2004).
- 114.
Ungvari, Z. et al. Estrés oxidativo en la senescencia vascular: lecciones de especies envejecidas con éxito. Delante. Biosci. 13, 5056–5070 (2008).
- 115.
Vyssokikh, M. Y. et al. La despolarización leve de la membrana mitocondrial interna es un componente crucial de un programa antienvejecimiento. Nosotros.
- 116.
Chattopadhyay, B., Garg, K.M., Ray, R., Mendenhall, I. H. & Rheindt, F. E. Novel de novo genome of Cynopterus brachyotis revela cambios evolutivamente abruptos en la composición de la familia genética a través de murciélagos frutales. Genoma Biol. Evol. 12, 259–272 (2020).
- 117.
Hawkins, J. A. et al. Un metaanálisis de la filogenética de murciélagos y selección positiva basada en genomas y transcriptomas de 18 especies. Nosotros. UU. 116, 11351–11360 (2019).
- 118.
Takeuchi, O. & Akira, S. Receptores de reconocimiento de patrones e inflamación. Celda 140,805–820 (2010).
- 119.
Iwasaki, A. Una visión virológica del reconocimiento inmune innato. Annu. Microbiol. 66, 177–196 (2012).
- 120.
Barbero, G. N. STING: infección, inflamación y cáncer. Nat. 15, 760–770 (2015).
- 121.
Li, N. et al. La infección por gripe induce daño al ADN del huésped y respuestas dinámicas del daño del ADN durante la regeneración tisular. La celda. Mol. Life Sci. 72, 2973-2988 (2015).
- 122.
Lupfer, C., Malik, A. & Kanneganti, T. D. Control inflamaso de la infección viral. Curr. Opin. Virol. 12, 38–46 (2015).
- 123.
Chen, I. Y., Moriyama, M., Chang, M. F. & Ichinohe, T. Síndrome respiratorio agudo grave coronavirus viroporina 3a activa el NLRP3 inflamammas. Delante. Microbiol. 10, 50 (2019).
- 124.
Nieto-Torres, J. L. et al. La proteína coronavirus E del síndrome respiratorio agudo grave transporta iones de calcio y activa el inflammasoma NLRP3. Virología 485, 330–339 (2015).
- 125.
Yaqinuddin, A. & Kashir, J. Nuevas dianas terapéuticas para la lesión pulmonar aguda inducida por SARS-CoV-2: apuntando a un potencial il-1o/neutrófilo trampas extracelulares bucle de retroalimentación. Hipótesis 143, 109906 (2020).
- 126.
Freeman, T. L. & Swartz, T. H. Apuntando al inflammasome NLRP3 en COVID-19 grave. Delante. Inmunol. 11, 1518 (2020).
- 127.
Ahn, M., Cui, J., Irving, A. T. & Wang, L. F. Pérdida única de la familia del gen PYHIN en murciélagos entre mamíferos: implicaciones para la detección inflammasa. Sci. Rep. 6, 21722 (2016).
- 128.
Schattgen, S. A. & Fitzgerald, K. A. La familia de proteínas PYHIN como mediadores de las defensas del huésped. Inmunol. Rev. 243, 109–118 (2011).
- 129.
Lamkanfi, M. & Dixit, V.M. Mecanismos y funciones de los inflammasomas. Celda 157, 1013–1022 (2014). Un documento de revisión clave en el campo de la biología inflamable.
- 130.
Wang, K. et al. Mecanismo estructural para la focalización de GSDMD por caspasas autoprocesadas en piroptosis. Celda 180,941–955 (2020).
- 131.
Goh, G. et al. La regulación complementaria de la caspasa-1 y la IL-1 revela mecanismos adicionales de inflamación amortiguada en los murciélagos. Nosotros. UU. 117, 28939–28949 (2020).
- 132.
Banerjee, A., Rapin, N., Bollinger, T. & Misra, V. Falta de expresión génica inflamatoria en murciélagos: un papel único para un represor de transcripción. Sci. Rep. 7, 2232 (2017).
- 133.
Yong, K. S.M. et al. Quimera de médula ósea murciélago-ratón: un novedoso modelo animal para diseccionar la singularidad del sistema inmunológico murciélago. Sci. Rep. 8, 4726 (2018).
- 134.
Escalera-Zamudio, M. et al. La evolución de los receptores similares al ácido nucleico de murciélago. Mol. Ecol. 24, 5899–5909 (2015).
- 135.
OASes y STING: adaptive evolution in concert. Genoma Biol. Evol. 7, 1016-1032 (2015).
- 136.
Lu, D. et al. La presentación de péptidos por murciélago MHC clase I proporciona una nueva visión de la inmunidad antiviral de los murciélagos. PLoS Biol. 17, e3000436 (2019).
- 137.
Wynne, J. W. et al. Caracterización de la maquinaria de procesamiento de antígenos y presentación de péptido endógeno de una molécula bat MHC clase I. J. Inmunol. 196, 4468–4476 (2016).
- 138.
Ng, J. H. et al. Evolución y análisis comparativo de la región bat MHC-I. Sci. Rep. 6, 21256 (2016).
- 139.
Qu, Z. et al. Estructura y peptidomo de la molécula bat MHC clase I revelan un mecanismo novedoso que conduce a la unión de péptidos de alta afinidad. J. Inmunol. 202, 3493–3506 (2019).
- 140.
Salmier, A., de Thoisy, B., Crouau-Roy, B., Lacoste, V. & Lavergne, A. Patrón espacial de diversidad genética y selección en la clase MHC II DRB de tres especies de murciélagos neotropicales. BMC Evol. Biol. 16, 229 (2016).
- 141.
Ng, J. H. J., Tachedjian, M., Wang, L. F. & Baker, M. L. Insights into the ancestral organisation of the mammalian MHC class II region from the genome of the pteropid bat, Pteropus alecto. BMC Genomics 18, 388 (2017).
- 142.
Brook, C. E. et al. Dinámica viral acelerada en líneas celulares de murciélagos, con implicaciones para la aparición zoonótica. eLife 9, e48401 (2020).
- 143.
Guo, H., Callaway, J.B. & Ting, J. P. Inflammasomes: mecanismo de acción, papel en la enfermedad y terapéuticos. Nat. Med. 21, 677–687 (2015).
- 144.
Gamage, A.M. et al. Monocitos de inmunofenotipado, macrófagos y granulocitos en el murciélago pteropodido Eonycteris spelaea. Sci. Rep. 10, 309 (2020).
- 145.
Edenborough, K.M. et al. Las células dendríticas generadas a partir de Mops condylurus, un probable huésped del reservorio de filovirus, son susceptibles y activados por la infección por el virus del ebolatario Zaire. Delante. Inmunol. 10, 2414 (2019).
- 146.
Zhou, P. et al. Desbloqueo de la inmunología de murciélagos: establecimiento de células y macrófagos derivados de médula ósea Pteropus alecto. Sci. Rep. 6, 38597 (2016).
- 147.
Jebb, D. et al. Seis genomas de calidad de referencia revelan la evolución de las adaptaciones de murciélagos. Naturaleza 583, 578–584 (2020).
- 148.
Gibbs, E.P.J. La evolución de One Health: una década de progreso y desafíos para el futuro. Vet. Rec. 174, 85–91 (2014).
- 149.
Teeling, E.C. et al. Una filogenia molecular para murciélagos ilumina la biogeografía y el registro fósil. Ciencia 307, 580–584 (2005). Un análisis exhaustivo a escala temporal de la filogenia molecular de todos los murciélagos existentes que validó los subordenes Yinpterochiroptera y Yangochiroptera, predijo el ancestro común de los murciélagos y sugiere que sus orígenes evolutivos estaban en Laurasia (posiblemente América del Norte).
- 150.
McCracken, G. F. en el monitoreo de las tendencias en las poblaciones de murciélagos de los Estados Unidos y los territorios: problemas y perspectivas. United States Geological Survey, Biological Resources Discipline, Information and Technology Report, USGS/BRD/ITR-2003–003 (eds O’Shea, T. J. & Bogan, M. A.) 21–30 (US Geological Survey, 2003).
- 151.
Norris, D. O. & Lopez, K. H. Hormones and Reproduction of Vertebrates Vol. 1 (Academic, 2010).
- 152.
Burbank, R.C. & Young, J. Z. Cambios de temperatura y sueño invernal de murciélagos. J. Physiol. (Lond.) 82, 459–467 (1934).
- 153.
Dietz, C. & Kiefer, A. Bats of Britain and Europe (Bloomsbury, 2016).
- 154.
Reeder, W. G. & Cowles, R.B. Aspectos de la termorregulación en murciélagos. J. Mamm. 32, 389–403 (1951).
- 155.
Davis, W. H. & Reite, O.B. Respuestas de murciélagos de regiones templadas a cambios en la temperatura ambiente. Toro Biol. 132, 320–328 (1967).
- 156.
Ossa, G., Kramer-Schadt, S., Peel, A. J., Scharf, A. K. & Voigt, C.C. La ecología del movimiento del murciélago de frutas de color paja, Eidolon helvum, en el Africa subsahariana evaluada por proporciones estables de isótopos. PLoS ONE 7, e45729 (2012).
- 157.
Morrison, P. & McNab, B. K. Regulación de temperatura en algunos murciélagos filostomid brasileños. Bioquímica. Physiol. 21, 207–221 (1967).
- 158.
Johansen, M. D. et al. Modelos animales y traslacionales de la infección por SARS-CoV-2 y COVID-19. Mucosal Immunol. 13, 877–891 (2020).
- 159.
Coronaviridae Study Group del Comité Internacional de Taxonomía de Virus. La especie Coronavirus grave relacionado con el síndrome respiratorio agudo:clasificar 2019-nCoV y nombrarlo SARS-CoV-2. Microbiol . 5, 536–544 (2020).
- 160.
Fan, C. et al. Predicción de la propagación epidémica del coronavirus novel 2019 impulsado por el transporte del festival de primavera en China: un estudio basado en la población. Int. J. Environ. Salud Pública 17, 1679 (2020).
Agradecimientos
Investigación en el grupo de L.-F.W. cuenta con el apoyo de subvenciones de la Fundación Nacional de Investigación de Singapur (NRF2012NRF-CRP001-056 y NRF2016NRF-NSFC002-013), la Consejo de Singapur (MOH-OFIRG19MAY-0011 y COVID19RF-003) y el Ministerio de Educación de Singapur (MOE2019-T2-2-130). A.T.I. cuenta con el apoyo del Consejo Nacional de Investigación Médica de Singapur (NMRC/BNIG/2040/2015) y un fondo especial de investigación científica de la Universidad de Zhejiang para la prevención y el control COVID-19.
Declaraciones éticas
Intereses competitivos
Los autores no declaran intereses en competencia.
Información adicional
Información de revisión por pares Nature agradece a Fabian Leendertz, Silke Stertz y a los otros revisores anónimos por su contribución a la revisión por pares de este trabajo.
Nota del editor Springer Nature sigue siendo neutral con respecto a las reclamaciones jurisdiccionales en los mapas publicados y las afiliaciones institucionales.